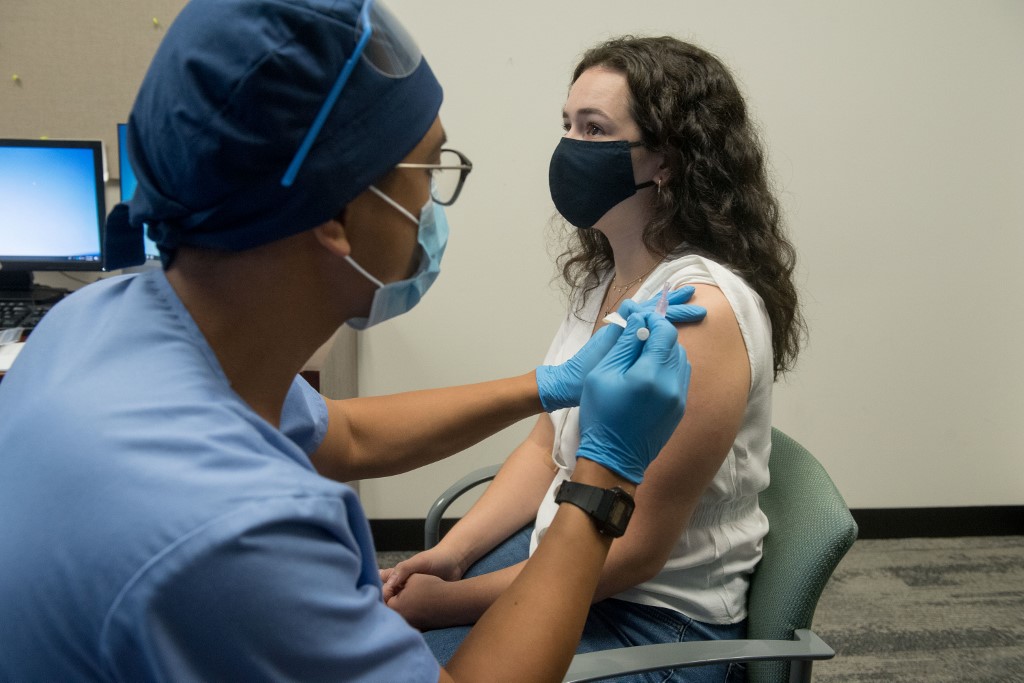
Moderna anunció que presentará este lunes solicitudes de autorización de emergencia para su vacuna contra el Covid-19 en Estados Unidos y en Europa, luego de que resultados confirmaran una alta eficacia de la misma (94.1 %).
La compañía estadounidense reportó que de 196 participantes en su ensayo clínico que se infectaron con Covid-19, 185 pertenecían al grupo placebo y 11 al grupo vacunado. Esto significa que las personas vacunadas vieron reducido su riesgo de contraer Covid-19 en un 94 % en comparación con las personas que no fueron vacunadas.
Ninguna forma grave de la enfermedad se registró en el grupo vacunado, contra 30 en el grupo placebo.
Moderna informó asimismo que no se observaron nuevos efectos secundarios graves en los voluntarios vacunados, aunque no dijo explícitamente si inicialmente se observaron efectos secundarios graves.

El pasado 16 de noviembre, la compañía anunció, no obstante, que la vacuna era “generalmente bien tolerada” y que no había suscitado “preocupaciones de seguridad importantes”.
Las reacciones más frecuentes fueron dolor alrededor del lugar de la inyección en el brazo, fatiga, rigidez muscular o dolor de cabeza.
Un participante del ensayo clínico murió, pero estaba en el grupo de placebo.
Eficacia de 94.1 %
Moderna informó, además, que la eficacia observada de su vacuna fue uniforme según la edad, el género y la etnia.
“Este análisis positivo preliminar confirma la capacidad de nuestra vacuna para prevenir el Covid-19 con una eficiencia del 94.1 % y, significativamente, la capacidad para prevenir la forma grave de Covid-19”, dijo el director ejecutivo de Moderna, Stéphane Bancel.
La compañía presentará lo que en Estados Unidos se denomina una solicitud de autorización de emergencia a la Agencia de Medicamentos (FDA), que se espera convoque a su comité asesor sobre vacunas el 17 de diciembre.
Esto podría permitir, en caso de luz verde, una distribución en los días siguientes.
Moderna también presentará este lunes una solicitud de uso condicional a la Agencia Europea de Medicamentos (EMA).
La vacuna Pfizer/BioNTech ya está siendo evaluada por la FDA y podría autorizarse poco después del 10 de diciembre.
*Con información de AFP